近年来,纳米材料在生物医学领域,特别是药物输送和基因转染中,得到了广泛应用。将纳米材料高效输送到特定细胞内部是当前科学研究中的一项重要挑战,这既需要纳米材料有效穿过细胞膜进入细胞,又需要纳米材料进入细胞后克服一系列的细胞内生理屏障,如溶酶体逃逸等。之前的研究表明,纳米材料的细胞输运是一个极为复杂的过程,包括纳米材料的物理化学性质(大小、形状、刚度)和表面修饰(高分子和特异性配体)等多个因素共同影响了这一过程。然而,配体嫁接到纳米颗粒上的方式,即配体嫁接策略,对细胞摄取的影响却鲜有涉及,也一直是一个难以捉摸的难题。
为了解决上述难题,丁泓铭教授课题组与实验团队合作,以广泛应用的金纳米颗粒(NP)为例,通过引入三种功能端相同但锚定位点不同的配体,全面评估了配体嫁接策略与NP摄取行为之间的关系(图1)。首先,结合第一性原理计算和细胞实验,发现NP摄取效率与配体-NP间“键”的强度(更确切地说是配体在NP表面的活动性)呈正相关——增强NP与配体间作用强度可降低NP表面的配体活动性,从而提高NP摄取效率。为了揭示上述现象的物理机制,我们进行了大规模的耗散粒子动力学(DPD)模拟,系统研究了不同配体修饰纳米颗粒被细胞包裹的全过程。模拟结果表明,在包裹过程中NP表面的配体会在配体-受体特异性作用下出现各向异性分布,增强NP与配体间作用可以抑制这种不均匀分布,从而促进NP的完全包裹。我们还提出一个NP与可移动配体包裹的统计热力学模型,对这一关联进行了理论解释。最后,通过实验,我们还发现配体嫁接策略不仅能够影响NP的内吞效率,还能够影响了NP的内吞途径:Cdc42依赖性途径(CLIC-GEEC)和endophilin蛋白介导的FEME途径对配体活动性更为敏感,而配体活动性对传统Clathrin或Caveolin介导的内吞途径影响不大。总体而言,这项工作提供了关于先前忽视的配体嫁接策略对纳米颗粒摄取行为影响的深刻见解,并为调控纳米颗粒的生物学行为提供了一种有前途的策略——这一策略无需改变纳米颗粒类型或其表面修饰配体的功能。这项工作以“Uncovering the Importance of Ligand Mobility on Cellular Uptake of Nanoparticles: Insights from Experimental, Computational, and Theoretical Investigations”为题发表在【ACS Nano, 18, 6463–6476 (2024)】。
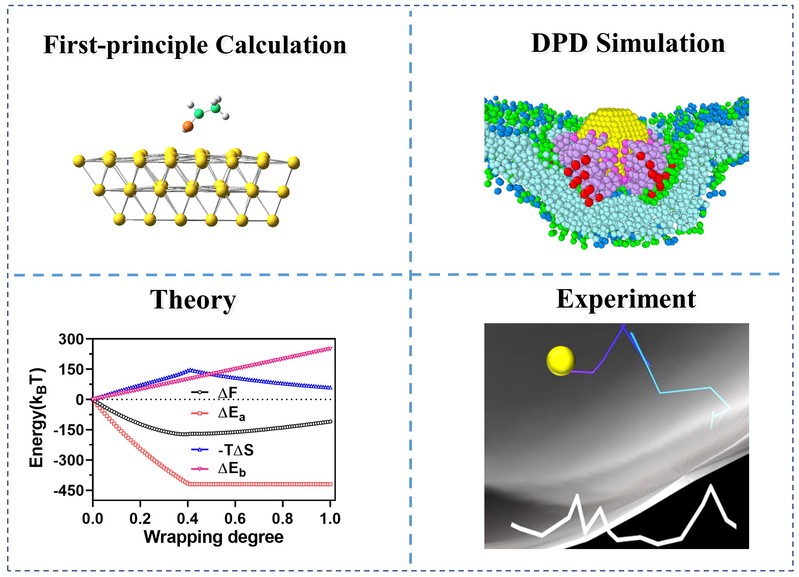
图1. 结合第一性原理计算、耗散粒子动力学模拟、统计热力学理论和高分辨成像实验等多种研究手段,深刻揭示配体嫁接策略影响纳米颗粒内吞行为的内在机制。
纳米材料通过内吞作用进入细胞后还需从内吞体/溶酶体中逃逸出来才能发挥其功能。之前的研究表明,带(正)电纳米材料的溶酶体逃逸主要通过质子海绵效应实现;然而,中性纳米材料的溶酶体逃逸机制尚未得到很好的揭示。针对这一问题,我们进一步与实验合作,深入研究了中性金纳米颗粒的溶酶体逃逸机制(图2)。我们首先运用DPD模拟系统研究了NP在摄取后如何与溶酶体作用的时间演变过程,并发现了一种名为“挤出”模式的机制,这种机制主要是通过NP表面两种不同PEG配体(一种为带特异性基团的PEG,另一种为常规PEG)的相分离实现。通过单分子成像,我们在实验中观察到带特异性基团的PEG配体在溶酶体内得以保留,从而支持“挤出”模式是NP逃逸溶酶体的机制。此外,我们证明这一过程对溶酶体相对无害,NP逃逸仅仅是以牺牲表面部分PEG配体为代价。更为重要的是,我们还揭示通过精确调控纳米颗粒从溶酶体逃逸的效果,可以实现对细胞内不同通路和代谢机制的调节,从而提供了一种简便而强大的具备可控溶酶体逃逸效能的纳米医学工具。这项工作以“Ligand Phase Separation-Promoted, “Squeezing-Out” Mode Explaining the Mechanism and Implications of Neutral Nanoparticles That Escaped from Lysosomes”为题发表在【ACS Nano, 18, 2162–2183 (2024)】。
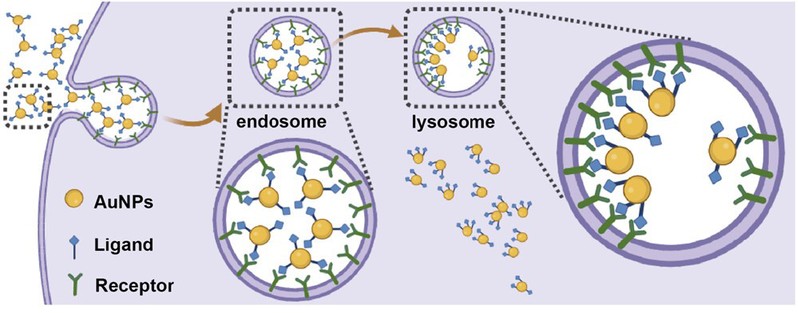
图2. 中性金纳米颗粒从细胞溶酶体中逃逸的“挤出”机制示意图。
上述两项工作是与南京大学马余强院士课题组、胡勇教授课题组和南京医科大学霍达教授课题组等合作完成。丁泓铭教授是两篇文章的共同通讯作者,苏州大学2022级博士研究生陈远强是两篇文章的并列一作(分别排名第一和第二)。这一系列工作得到了国家自然科学基金优秀青年基金、理论物理专款(复杂系统理论物理中心)、面上项目等的支持。
文章链接:


